Pernahkah kamu melihat besi yang beberapakali terkena air lalu berubah menjadi karat? Itu lah salah satu contoh dari reaksi redoks dalam kehidupan sehari-hari. Reaksi ini memang cukup dekat dengan kegiatan yang dilakukan manusia.
Penasaran mengenai reaksi redoks ini? Simak rangkuman materi kimia reaksi redoks mulai dari pengertian, konsep, ciri-ciri, rumus hingga contoh soalnya berikut ini!
Pengertian Reaksi Redoks (Reduksi-Oksidasi)
Reaksi redoks (reduksi–oksidasi) adalah reaksi kimia yang melibatkan proses transfer elektron antara dua zat. Dalam reaksi ini, satu zat mengalami oksidasi (melepaskan elektron) sedangkan zat lainnya mengalami reduksi (menerima elektron). Jadi, oksidasi dan reduksi selalu terjadi secara bersamaan, tidak bisa berdiri sendiri. Proses ini sering ditandai dengan perubahan bilangan oksidasi suatu unsur dalam senyawa atau ion.
Seperti yang sudah disingung sebeumnya, dalam kehidupan sehari-hari, reaksi redoks sangat penting karena menjadi dasar dari banyak fenomena alam maupun teknologi. Contohnya, proses pernapasan manusia, fotosintesis pada tumbuhan, perkaratan besi, hingga pembakaran bahan bakar dan kerja baterai. Semua contoh ini memperlihatkan bagaimana reaksi redoks berperan dalam menyediakan energi, menopang kehidupan, serta memengaruhi berbagai aktivitas manusia.
Konsep Reaksi Redoks
Reaksi redoks dapat dipahami dengan tiga sudut pandang konsep. Simak selengkapnya berikut ini!
1. Berdasarkan Perpindahan Elektron
- Oksidasi adalah proses ketika suatu zat melepaskan elektron, sehingga muatannya menjadi lebih positif.
- Reduksi adalah proses ketika suatu zat menerima elektron, sehingga muatannya menjadi lebih negatif.
2. Berdasarkan Pengikatan atau Pelepasan Oksigen
- Oksidasi: terjadi jika suatu zat mengikat oksigen. Artinya, zat tersebut bereaksi dengan oksigen dan membentuk senyawa baru.
- Reduksi: terjadi jika suatu zat melepaskan oksigen. Artinya, senyawa yang semula mengandung oksigen akan berubah menjadi zat lain dengan jumlah oksigen lebih sedikit atau tanpa oksigen.
3. Berdasarkan Perubahan Bilangan Oksidasi
- Oksidasi: terjadi jika bilangan oksidasi suatu unsur meningkat, artinya unsur tersebut kehilangan elektron.
- Reduksi: terjadi jika bilangan oksidasi suatu unsur menurun, artinya unsur tersebut menerima elektron.
Ciri-ciri Reaksi Redoks
Agar lebih mengenal reaksi redoks, kamu harus tahu nih ciri-ciri dari reaksi ini. Intip beberapa cirinya berikut ini!
- Terjadi oksidasi dan reduksi secara bersamaan.
- Ada perpindahan elektron dari zat yang teroksidasi ke zat yang tereduksi.
- Mengalami perubahan bilangan oksidasi pada unsur-unsurnya.
- Bisa melibatkan penambahan atau pelepasan oksigen dalam suatu zat.
- Bisa melibatkan penambahan atau pelepasan hidrogen dalam suatu zat.
- Selalu terdapat zat pengoksidasi (oksidator) dan zat pereduksi (reduktor).
Rumus Reaksi Redoks
Sebab konsep reaksi redoks dibagi menjadi tiga sudut pandang, maka akan lebih mudah memahaminya akan dipaparkan 3 rumus berbeda. Intip dibawah ini!
1. Berdasarkan Perpindahan Elektron
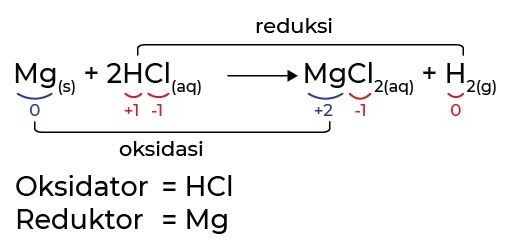
Sumber: Ruangguru
Keterangan:
- Magnesium (Mg)
- Awalnya bilangan oksidasi Mg = 0.
- Setelah bereaksi menjadi Mg²⁺ pada MgCl₂, bilangan oksidasi naik jadi +2.
- Artinya Mg mengalami oksidasi (melepaskan 2 elektron).
- Karena melepaskan elektron, Mg disebut reduktor.
- HCl
- H dalam HCl memiliki bilangan oksidasi +1, Cl = –1.
- Setelah reaksi, Cl⁻ tetap sebagai ion dalam MgCl₂ (bilangan oksidasi tetap –1, tidak berubah).
- Sedangkan H⁺ (dari HCl) menerima elektron dari Mg lalu berubah menjadi H₂ (bilangan oksidasi turun dari +1 → 0).
- Jadi H⁺ mengalami reduksi (menerima elektron).
- Karena menyebabkan reduksi, HCl disebut oksidator.
- Kesimpulan Reaksi
- Oksidasi: Mg → Mg²⁺ + 2e⁻
- Reduksi: 2H⁺ + 2e⁻ → H₂
- Terjadi perpindahan elektron: Mg melepaskan elektron, H⁺ menerima elektron.
- Maka reaksi ini adalah reaksi redoks berdasarkan perpindahan elektron.
Jadi jelas bahwa Mg bertindak sebagai pereduksi, sedangkan HCl (tepatnya ion H⁺ di dalamnya) bertindak sebagai pengoksidasi.
2. Berdasarkan Pengikatan atau Pelepasan Oksigen

Sumber: blogkimia
Keterangan:
a. Tembaga (Cu)
- Awalnya Cu dalam keadaan unsur (bilangan oksidasi 0).
- Setelah reaksi, Cu berubah menjadi Cu²⁺ di dalam Cu(NO₃)₂.
- Cu mengikat oksigen melalui ion nitrat (NO₃⁻) → ini berarti Cu mengalami oksidasi.
- Jadi Cu adalah pereduksi.
b. Nitrogen dalam HNO₃
- Awalnya N dalam HNO₃ memiliki bilangan oksidasi +5.
- Setelah reaksi, sebagian berubah menjadi NO₂ dengan bilangan oksidasi +4.
- Artinya N melepaskan satu oksigen (dari NO₃⁻ menjadi NO₂) → ini berarti mengalami reduksi.
- Jadi HNO₃ berperan sebagai pengoksidasi.
c. Kesimpulan
- Oksidasi (penambahan oksigen): Cu → Cu(NO₃)₂
- Reduksi (pelepasan oksigen): HNO₃ (N +5) → NO₂ (N +4)
- Dengan demikian, reaksi ini memang reaksi redoks berdasarkan pengikatan dan pelepasan oksigen.
3. Berdasarkan Perubahan Bilangan Oksidasi
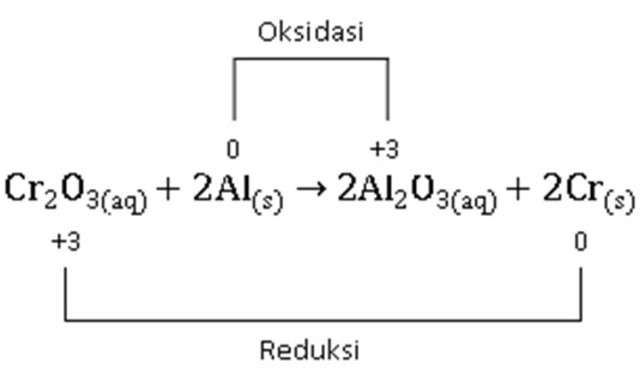
Sumber: Kumparan
Keterangan:
a. Kromium (Cr)
- Dalam Cr₂O₃ bilangan oksidasi Cr = +3.
- Setelah reaksi menjadi Cr unsur, biloks turun jadi 0.
- Artinya Cr mengalami reduksi.
b. Aluminium (Al)
- Awalnya Al unsur, bilangan oksidasi = 0.
- Setelah reaksi menjadi Al³⁺ dalam Al₂O₃, biloks naik jadi +3.
- Artinya Al mengalami oksidasi.
c. Kesimpulan
- Oksidasi: Al (0) → Al³⁺ (+3)
- Reduksi: Cr³⁺ (+3) → Cr (0)
- Reduktor: Al (karena mengalami oksidasi)
- Oksidator: Cr₂O₃ (karena Cr di dalamnya mengalami reduksi)
Contoh Soal Reaksi Redoks
Cara beleajar kimia selain hafal dan paham rumus tentu adalah rajin berlatih. Dibawah ini contoh soal reaksi redoks untuk referensi kamu!
Dalam suatu reaksi redoks, zat yang bertindak sebagai oksidator adalah …
A. Zat yang melepaskan elektron
B. Zat yang mengalami kenaikan bilangan oksidasi
C. Zat yang menerima elektron
D. Zat yang mengalami oksidasi
E. Zat yang berperan sebagai reduktor
Jawaban yang benar: C
Pembahasan
- Oksidasi = pelepasan elektron (bilangan oksidasi naik). Zat yang mengalami oksidasi disebut reduktor.
- Reduksi = penerimaan elektron (bilangan oksidasi turun). Zat yang mengalami reduksi disebut oksidator.
- Dengan demikian, oksidator adalah zat yang menerima elektron.
Yuk, Belajar Bareng Skuling!
Kalau mau lebih banyak latihan soal kimia, entah untuk ujian sekolah ataupun persiapan UTBK sejak dini, kamu bisa banget belajar di Skuling, website belajar UTBK gratis. Ada banyak layanan yang bisa diakses, mulai dari ribuan soal up-to-date, pembahasan detail, hingga fitur belajar interaktif.
Nah, kalau ingin fitur yang lebih canggih, kamu bisa upgrade ke Skuling Pro dengan keunggulan seperti Tryout UTBK berbasis AI-powered Item Response Theory, Skuling Freestyle dengan ribuan soal, sampai kelas live eksklusif bareng tutor berpengalaman.
Selain itu, jangan lewatkan juga Blog Skuling yang penuh dengan informasi penting seputar dunia pendidikan, tips UTBK, strategi masuk PTN, hingga beasiswa. Jadi, bukan cuma belajar soal, kamu juga bisa menambah wawasan untuk perjalanan akademikmu. Yuk, belajar bareng Skuling!

