Materi reaksi asam-basa bukan hal yang asing lagi muncul dalam mata pelajaran Kimia. Kamu yang duduk di jenjang SMA pasti sudah akrab dengan kedua istilah tersebut. Asam dan basa cukup dekat dengan kehidupan kita sehari-hari.
Nah, buat kamu yang baru mempelajari materi ini, tidak perlu khawatir. Berikut penjelasan lengkap mulai dari pengertian, jenis, ciri-ciri, rumus hingga contoh soalnya. Selengkapnya simak dibawah ini!
Pengertian Reaksi Asam-Basa
Reaksi asam-basa adalah reaksi kimia yang terjadi antara senyawa asam dan basa. Pada dasarnya, reaksi ini melibatkan pelepasan dan penerimaan ion H⁺ (proton) atau pasangan elektron, tergantung teori yang digunakan. Menurut teori Arrhenius, reaksi asam-basa terjadi ketika asam melepaskan ion H⁺ dan basa melepaskan ion OH⁻, lalu keduanya bergabung membentuk air.
Dalam konteks Bronsted-Lowry, reaksi asam-basa terjadi karena adanya transfer proton, yaitu asam bertindak sebagai donor H⁺ dan basa sebagai akseptor H⁺. Sedangkan menurut teori Lewis, reaksi ini terjadi karena adanya pasangan elektron yang ditransfer dari basa (pemberi elektron) ke asam (penerima elektron). Jadi, secara umum reaksi asam-basa bisa dipahami sebagai interaksi kimia yang menghasilkan garam, air, atau senyawa lain, serta menjadi dasar dari banyak fenomena yang kita jumpai sehari-hari, mulai dari pembuatan sabun, obat maag, hingga proses pencernaan dalam tubuh.
Jenis-jenis Reaksi Asam-Basa
Reaksi kimia yang dihasilkan oleh senyawa asam dan basa memiliki beberapa jenis. Simak berikut ini!
1. Reaksi Netralisasi
- Asam dan basa bila dicampur akan bereaksi dan menghasilkan garam dan air.
2. Reaksi Hidrolisis Garam
- Garam bereaksi dengan air dan menghasilkan larutan yang bisa bersifat asam, basa, atau netral.
3. Reaksi Penyangga (Buffer)
- Reaksi antara asam lemah dengan basa konjugasinya (atau sebaliknya) yang dapat menjaga pH tetap stabil.
4. Reaksi Asam-Basa Menurut Bronsted-Lowry
- Terjadi karena transfer proton (H⁺) dari asam ke basa.
Ciri-ciri Reaksi Asam-Basa
Setelah memahami pengertian dan jenis-jenis reaksi asam-basa, langkah berikutnya adalah mengenali ciri-ciri yang muncul saat reaksi ini berlangsung. Berikut ciri-ciri reaksi asam basa!
- Terjadi netralisasi: Asam dan basa saling bereaksi membentuk garam dan air.
- Perubahan pH: Larutan asam-basa yang bereaksi akan mengalami perubahan pH, biasanya mendekati netral.
- Perubahan suhu (eksoterm): Umumnya reaksi asam-basa melepaskan kalor, sehingga larutan terasa lebih hangat.
- Pembentukan garam: Hasil utama reaksi asam-basa adalah terbentuknya senyawa garam.
- Dapat diamati dengan indikator: Warna indikator (lakmus, PP, metil jingga, dsb.) akan berubah selama atau setelah reaksi terjadi.
- Terjadi pertukaran ion: Ion H⁺ dari asam bereaksi dengan ion OH⁻ dari basa menghasilkan molekul H₂O.
Rumus Reaksi Asam-Basa
Tiap reaksi asam-basa mempunyai rumus masing-masing. Berikut beberapa rumus yang umumnya digunakan dalam beberapa jenis reaksi!
1. Reaksi Netralisasi
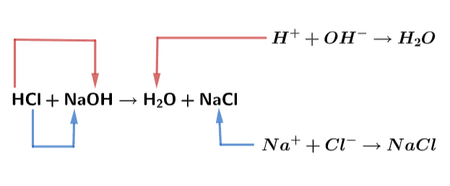
Sumber: Study.com
HCl = asam klorida yang berperan sebagai asam kuat dan melepaskan ion H⁺
NaOH = natrium hidroksida yang berperan sebagai basa kuat dan melepaskan ion OH⁻
H₂O = air yang terbentuk dari hasil penggabungan ion H⁺ dan ion OH⁻
NaCl = garam natrium klorida yang terbentuk dari penggabungan ion Na⁺ dan ion Cl⁻
Dengan demikian, reaksi HCl + NaOH merupakan reaksi netralisasi yang menghasilkan air dan garam sebagai produk akhirnya.
2. Reaksi Hidrolisis Garam
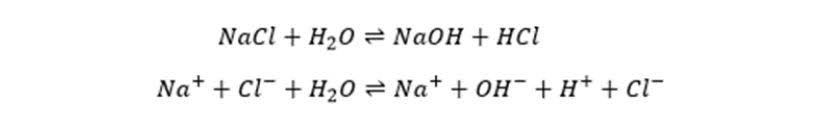
Sumber: Aku Pintar
Persamaan 1:
- NaCl = natrium klorida, garam yang berasal dari basa kuat (NaOH) dan asam kuat (HCl).
- H₂O = air, berfungsi sebagai pelarut.
- NaOH = natrium hidroksida, basa kuat.
- HCl = asam klorida, asam kuat.
Hasil reaksi: larutan tidak benar-benar menghasilkan NaOH dan HCl kembali, karena NaCl hanya larut menjadi ion-ionnya. Jadi, larutan NaCl tetap bersifat netral (pH = 7).
Persamaan 2:
- Na⁺ = kation natrium, berasal dari basa kuat, tidak terhidrolisis.
- Cl⁻ = anion klorida, berasal dari asam kuat, tidak terhidrolisis.
- H₂O = air, pelarut.
- OH⁻ = ion hidroksida, penyebab larutan bersifat basa bila jumlahnya berlebih.
- H⁺ = ion hidrogen (proton), penyebab larutan bersifat asam bila jumlahnya berlebih.
Hasil reaksi: dalam kenyataannya, Na⁺ dan Cl⁻ tidak bereaksi dengan air sehingga tidak menghasilkan kelebihan H⁺ atau OH⁻. Larutan tetap netral (pH = 7).
3. Reaksi Penyangga (Buffer)
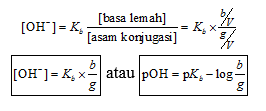
Sumber: Studiobelajar.com
Pada gambar tersebut, ditunjukkan rumus untuk menghitung konsentrasi ion hidroksida [OH−][OH−] dari larutan garam yang mengalami hidrolisis basa. Proses ini biasanya terjadi pada garam yang berasal dari basa lemah dan asam kuat.
Keterangan rumus:
bKb = konstanta kesetimbangan basa lemah
[basa lemah][basa lemah] = konsentrasi basa lemah hasil hidrolisis
[asam konjugasi][asam konjugasi] = konsentrasi asam konjugasi dari garam tersebut
4. Reaksi Asam-Basa Menurut Bronsted-Lowry
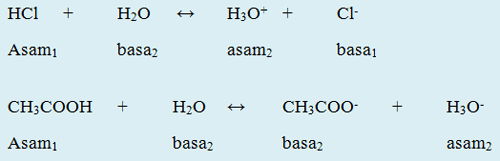
Sumber: Siswapedia
1. Reaksi HCl dengan H₂O
- HCl (asam₁) → bertindak sebagai asam karena memberikan proton (H⁺).
- H₂O (basa₂) → bertindak sebagai basa karena menerima proton (H⁺) dari HCl.
- H₃O⁺ (asam₂) → disebut asam konjugasi dari H₂O.
- Cl⁻ (basa₁) → disebut basa konjugasi dari HCl.
Pada reaksi ini, HCl adalah asam kuat sehingga reaksinya hampir sempurna menghasilkan ion H₃O⁺ dan Cl⁻.
2. Reaksi CH₃COOH dengan H₂O
- CH₃COOH (asam₁) → bertindak sebagai asam karena menyumbangkan proton (H⁺).
- H₂O (basa₂) → bertindak sebagai basa karena menerima proton dari CH₃COOH.
- CH₃COO⁻ (basa₁) → merupakan basa konjugasi dari CH₃COOH.
- H₃O⁺ (asam₂) → merupakan asam konjugasi dari H₂O.
Pada reaksi ini, CH₃COOH adalah asam lemah, sehingga reaksinya bersifat kesetimbangan, tidak semuanya terionisasi menjadi CH₃COO⁻ dan H₃O⁺.
Contoh Soal Reaksi Asam-Basa
Tips belajar kimia salah satunya adalah sering berlatih soal. Simak contoh soal reaksi asam basa berikut!
Soal:
Dalam praktikum, Rani meneteskan asam klorida ke dalam air murni. Setelah tercampur, nilai pH larutan turun. Berdasarkan teori Brønsted–Lowry, pernyataan yang paling tepat adalah …
A. Asam klorida bertindak sebagai penerima proton, air sebagai pemberi proton; pasangan konjugasinya adalah asam klorida/klorida.
B. Asam klorida bertindak sebagai pemberi proton (asam) dan air sebagai penerima proton (basa); terbentuk asam konjugat berupa ion hidronium dan basa konjugat berupa ion klorida.
C. Asam klorida dan air sama-sama bersifat basa; pH turun hanya karena proses pelarutan.
D. Air bertindak sebagai asam dan asam klorida sebagai basa karena air jumlahnya lebih banyak.
Jawaban: B
Pembahasan:
Menurut teori Brønsted–Lowry, asam adalah pemberi proton dan basa adalah penerima proton. Ketika asam klorida dicampurkan ke air, asam klorida menyerahkan protonnya kepada air. Air yang menerima proton bertindak sebagai basa, sekaligus berubah menjadi asam konjugat (dikenal sebagai ion hidronium). Sisa asam klorida setelah melepas proton menjadi basa konjugat (ion klorida). Karena asam klorida termasuk asam kuat, proses penyerahan proton berlangsung hampir sempurna sehingga pH turun secara signifikan.
Pilihan A terbalik perannya, C mengabaikan konsep asam–basa, dan D keliru karena peran asam/basa tidak ditentukan oleh jumlah zat, melainkan oleh transfer proton.
Yuk, Belajar Bareng Skuling!
Kalau ingin lebih sering berlatih soal kimia, entah itu untuk ujian sekolah atau persiapan UTBK, kamu bisa coba belajar lewat Skuling. Skuling merupakan website belajar UTBK gratis dengan ribuan soal up-to-date yang bisa kamu akses secara gratis kapanpun kamu mau.
Nah, kalau kamu ingin latihan lebih maksimal, kamu bisa upgrade ke Skuling Pro. Ada banyak fitur keren yang bakal bantu persiapan UTBK, mulai dari Tryout UTBK dengan AI-powered Item Response Theory, Skuling Freestyle dengan 8.000+ soal, sampai Kelas Live Eksklusif. Bahkan ada juga fitur SmartCoin buat dapetin akses belajar lebih hemat.
Yuk, gabung sekarang di Skuling dan nikmati semua fiturnya!